탈수 반응
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
탈수 반응은 유기 화학 및 무기 화학에서 물 분자가 제거되는 화학 반응을 의미한다. 유기 화학에서는 에스터, 에테르, 나이트릴, 케텐, 알켄 등을 생성하는 데 사용된다. 특히 알코올의 탈수 반응은 알켄을 생성하며, 바이오매스를 액체 연료로 전환하는 데 활용된다. 무기 화학에서는 피로인산염 결합 형성 및 건축 자재 생산에 관여하며, 분자 간 탈수와 분자 내 탈수로 구분된다.
더 읽어볼만한 페이지
- 제거 반응 - 탈수소화
탈수소화는 분자에서 수소 원자를 제거하는 화학 반응으로, 석유화학 산업에서 방향족 화합물 및 올레핀, 폼알데하이드 생산 등 다양한 산업 공정에서 촉매를 사용하여 효율을 높이는 방법으로 널리 사용된다. - 제거 반응 - 호프만 제거
- 유기 반응 - 열분해
열분해는 고온에서 물질을 분해하는 과정으로, 다양한 산업과 에너지 분야에 활용되지만 안전 및 환경 문제도 고려해야 하며, 관련 분석 및 연구가 활발히 진행되고 있다. - 유기 반응 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다.
2. 유기 화학에서의 탈수 반응
물은 매우 안정적인 물질 중 하나로, 가열이나 탈수제와의 반응을 통해 쉽게 탈리된다.[1] 유기 화학에서 탈수 반응은 탄소-탄소 이중 결합, 에스터, 에테르, 나이트릴 등을 생성하는 데 중요한 역할을 한다.
카복실산과 알코올을 산 촉매 존재 하에서 가열하면 분자 간 탈수 반응이 일어나 에스터가 생성된다 (피셔 에스터 합성 반응).[1] 알코올에 농황산을 가하고 160–170°C로 가열하면 분자 내 탈수 반응이 일어나 이중 결합을 가진 에틸렌이 생성된다.[1]
물 분자를 직접 탈리시키기 위해서는 가혹한 조건이 필요하지만, 히드록시기를 더 좋은 이탈기로 변환하면 온화한 조건에서도 탈수 반응을 수행할 수 있다. 예를 들어, 알코올에 메탄술폰산 클로리드(메실 클로리드)를 작용시켜 술폰산 에스터를 만들고, 여기에 삼급 아민 등의 강염기를 반응시키면 메탄술폰산이 탈리되어 C=C 이중 결합이 생성된다.[1]
:
:
추가예프 탈리는 알코올에 이황화 탄소와 아이오딘화 메틸을 작용시켜 잔토겐산 에스터를 만들고, 이것을 열분해하여 알켄으로 변환하는 방법이다.[1]
:
:
2. 1. 에스터화 반응
피셔 에스테르화 반응은 카복실산을 알코올과 반응시켜 에스터를 생성하는 반응으로, 탈수 반응의 전형적인 예이다.[1]:RCO2H + R′OH RCO2R′ + H2O
이러한 반응은 종종 물과 반응하는 물질인 탈수제의 존재를 필요로 한다.[1] 물은 매우 안정적인 물질 중 하나이며, 가열이나 탈수제와의 반응을 통해 쉽게 탈리된다.[1] 예를 들어, 카르복실산 RCOOH와 알코올 R'OH를 산 등의 촉매 존재 하에서 혼합하여 가열하면, 분자 간에 물 분자 H2O가 생성되고, 남은 부분이 결합하여 에스터 RCOOR'가 생성된다(피셔 에스터 합성 반응).[1] 이러한 탈수 반응은 '''분자 간 탈수'''라고 불린다.[1] 본 예시는 첨가-제거 반응에 분류되는 반응이지만, 첨가-제거 반응에는 형식적으로 탈수 반응인 것이 매우 많다.[1]
2. 2. 에테르화 반응
두 분자의 알코올이 반응하여 에테르를 생성하는 반응이다. 단당류 두 분자가 글리코사이드 결합을 통해 이당류를 형성하는 것도 에테르화 반응의 일종이다.2. 3. 나이트릴 생성
1차 아마이드의 탈수 반응을 통해 나이트릴을 생성한다.[1]:RC(O)NH2 → RCN + H2O
2. 4. 케텐 생성
아세트산을 가열하고 생성물을 포획하여 케텐을 생성한다.[1]:CH3CO2H → CH2=C=O + H2O
2. 5. 알켄 생성
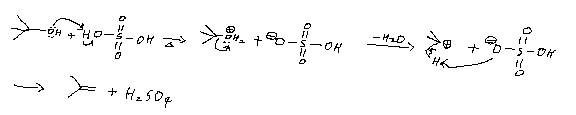


알켄은 알코올의 탈수 반응으로 만들 수 있다. 이 변환은 특히 바이오매스를 액체 연료로 전환하는 데 사용된다.[2] 에탄올을 에틸렌으로 전환하는 반응이 대표적인 예시이다:[3][4]
: CH3CH2OH → H2C=CH2 + H2O
이 반응은 황산이나 특정 제올라이트와 같은 산 촉매에 의해 가속화된다.
이러한 반응은 종종 탄소 양이온 중간체를 거쳐 진행되며, 사이클로헥산올의 탈수 반응에서 그 과정을 확인할 수 있다.[5]


어떤 알코올은 탈수 반응이 쉽게 일어난다. 알돌이라고 불리는 3-하이드록시 카보닐 화합물은 실온에 방치하면 물이 빠져나간다.
: RC(O)CH2CH(OH)R' → RC(O)CH=CHR' + H2O
이 반응은 탈수 시약을 사용하면 유도할 수 있다. 예를 들어 2-메틸-사이클로헥산-1-올은 물과 비가역적으로 반응하는 마틴 설푸란 시약 존재 하에 1-메틸사이클로헥센으로 탈수된다.[6][7]
글리세롤을 아크롤레인으로 전환하는 반응과 같이 이중 탈수 반응도 가능하다.[8][9]
알코올과 같이 히드록시기를 가진 화합물에 탈수제로 농황산을 가하고 160–170°C로 가열하면, 물 분자 하나가 떨어져 나가면서 이중 결합을 가진 에틸렌이 생성된다. (예: 에탄올 CH3CH2OH → 에틸렌 CH2=CH2) 이러한 반응을 '''분자 내 탈수'''라고 한다.
물 분자를 직접 제거하기 위해서는 위와 같이 높은 온도가 필요하다. 보다 낮은 온도에서 탈수 반응을 일으키기 위해 히드록시기를 더 좋은 이탈기로 바꾸는 방법이 사용된다. 예를 들어 알코올에 메탄술폰산 클로리드(메실 클로리드)를 반응시켜 술폰산 에스터를 만들고, 여기에 삼급 아민과 같은 강염기를 반응시키면 메탄술폰산이 떨어져 나가면서 C=C 이중 결합이 생성된다.
:
:
또한 알코올에 이황화 탄소와 아이오딘화 메틸을 작용시켜 잔토겐산 에스터를 만들고, 이것을 열분해하여 알켄으로 변환하는 방법은 「추가예프 탈리」라고 알려져 있다.
:
:
3. 무기 화학에서의 탈수 반응
무기 화학에서 탈수 반응은 피로인산염 결합 형성을 통해 생체 에너지와 관련된 반응에 응용된다.[10][11] 또한, 소석고와 같은 다양한 건축 자재 생산에도 활용된다.[10][11]
3. 1. 피로인산염 결합 형성
피로인산염 결합의 형성은 생체 에너지와 관련된 중요한 탈수 반응이다.[10][11]3. 2. 건축 자재 생산
소석고는 석고를 가마에서 탈수하여 생산한다.[10][11]:
이렇게 생성된 건조 분말은 물과 혼합하면 굳지만, 작업하기 쉬운 페이스트 형태가 되어 경화시킬 수 있다.
4. 분자 간 탈수와 분자 내 탈수
물은 매우 안정적인 물질 중 하나로, 가열이나 탈수제와의 반응을 통해 쉽게 탈리된다. 분자 간 탈수는 서로 다른 두 분자 사이에서 물 분자가 제거되는 반응이며, 분자 내 탈수는 한 분자 내에서 물 분자가 제거되는 반응이다.
카복실산과 알코올을 산 등의 촉매 존재 하에서 혼합하여 가열하면, 분자 간에 물 분자가 생성되고, 남은 부분이 결합하여 에스터가 생성된다(피셔 에스터 합성 반응).[1] 알코올 등 히드록시기를 가진 화합물에서 1분자의 물이 탈리되어 이중 결합을 가진 분자가 생성되는 것은 분자 내 탈수의 예시이다.
물 분자를 직접 탈리시키기 위해서는 가혹한 조건이 필요하다. 보다 온화하게 탈수 반응을 수행하기 위해서는, 히드록시기를 더 좋은 이탈기로 변환하는 방법이 사용된다. 예를 들어, 알코올에 메탄술폰산 클로리드(메실 클로리드)를 작용시켜 술폰산 에스터를 만들고, 여기에 삼급 아민 등의 강염기를 반응시키면, 메탄술폰산이 탈리되어 C=C 이중 결합이 생성된다.[1]
:
:
또한, 알코올에 이황화 탄소와 아이오딘화 메틸을 작용시켜 잔토겐산 에스터를 만들고, 이것을 열분해하여 알켄으로 변환하는 방법은 「추가예프 탈리」로 알려져 있다.[1]
:
:
4. 1. 분자 간 탈수
서로 다른 두 분자 사이에서 물 분자가 제거되는 반응이다. 카복실산과 알코올의 반응을 통해 에스터를 생성하는 피셔 에스테르화 반응이 대표적이다.[1]:RCO2H + R′OH RCO2R′ + H2O
이러한 반응은 종종 탈수제, 즉 물과 반응하는 물질의 존재를 필요로 한다.[1]
두 개의 단당류(예: 포도당과 과당)는 탈수 반응을 사용하여 결합하여 자당을 형성할 수 있다. 두 개의 단당류로 구성된 새로운 분자를 이당류라고 한다.[1]
물은 매우 안정적인 물질 중 하나이며, 가열이나 탈수제와의 반응을 통해 쉽게 탈리된다. 예를 들어, 카르복실산 RCOOH와 알코올 R'OH를 산 등의 촉매 존재 하에서 혼합하여 가열하면, 분자 간에 물 분자 H2O가 생성되고, 남은 부분이 결합하여 에스터 RCOOR'가 생성된다(피셔 에스터 합성 반응). 이러한 탈수 반응은 분자 간 탈수라고 불린다.[1]
4. 2. 분자 내 탈수
알코올 등 히드록시기를 가진 화합물, 예를 들어 에탄올 CH3CH2OH에 탈수제로서 농황산을 가하고 160–170°C로 가열하면, 1분자의 물이 탈리되어 이중 결합을 가진 에틸렌 CH2=CH2가 생성된다. 이러한 반응을 '''분자 내 탈수'''라고 한다.알켄은 알코올의 탈수 반응으로 만들 수 있다.[2] 에탄올을 에틸렌으로 전환하는 것은 기본적인 예이다:[3][4]
: CH3CH2OH → H2C=CH2 + H2O
이 반응은 황산과 특정 제올라이트와 같은 산 촉매에 의해 가속화된다.
이러한 반응은 종종 탄소 양이온 중간체를 통해 진행되며, 사이클로헥산올의 탈수 반응에서 볼 수 있다.[5]
어떤 알코올은 탈수에 취약하다. 알돌이라고 불리는 3-수산기 카르보닐은 실온에서 방치하면 물을 방출한다.
:RC(O)CH2CH(OH)R' → RC(O)CH=CHR' + H2O
이 반응은 탈수 시약에 의해 유도된다. 예를 들어, 2-메틸-사이클로헥산-1-올은 물과 비가역적으로 반응하는 마틴 설푸란의 존재하에 1-메틸사이클로헥센으로 탈수된다.[6][7]
이중 탈수는 글리세롤을 아크롤레인으로 전환하는 것으로 설명할 수 있다.[8][9]
물 분자를 직접 탈리시키기 위해서는 위와 같이 가혹한 조건을 필요로 한다. 보다 온화하게 탈수 반응을 수행하기 위해서는, 히드록시기를 더 좋은 이탈기로 변환하는 방법이 사용된다. 예를 들어, 알코올에 메탄술폰산 클로리드(메실 클로리드)를 작용시켜 술폰산 에스터를 만들고, 여기에 삼급 아민 등의 강염기를 반응시키면, 메탄술폰산이 탈리되어 C=C 이중 결합이 생성된다.
:
:
또한, 알코올에 이황화 탄소와 아이오딘화 메틸을 작용시켜 잔토겐산 에스터를 만들고, 이것을 열분해하여 알켄으로 변환하는 방법은 「추가예프 탈리」로 알려져 있다.
:
:
참조
[1]
서적
Ketenes
[2]
논문
Conversion of Biomass into Chemicals over Metal Catalysts
https://pubs.acs.org[...]
2014-02-12
[3]
서적
Ullmann's Encyclopedia of Industrial Chemistry
Wiley-VCH
[4]
논문
Dehydration of Ethanol to Ethylene
https://pubs.acs.org[...]
2013-07-17
[5]
논문
Cyclohexene
[6]
논문
Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment
[7]
서적
Diphenylbis(1,1,1,3,3,3-hexafluoro-2-phenyl-2-propoxy)sulfurane
[8]
논문
Acrolein
[9]
논문
Glycerol dehydration to acrolein in the context of new uses of glycerol
http://xlink.rsc.org[...]
2010
[10]
서적
Calcium Sulfate
Wiley-VCH
[11]
웹사이트
CaSO4, ½ H2O
http://www.lafargepr[...]
LafargePrestia
2008-11-27
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
